#1
工艺变更的要点
生物制品的变更管理,特别是工艺变更,一直是生物制药企业最为关注的热点和难点。在生物制品的生命周期中,随着对产品和工艺的理解加深、新技术新设备的应用、市场需求的增长以及生产成本的优化,不可避免的会对产品生产工艺等进行各种变更,常见的生物制品CMC变更有:
近年来, 随着《药品管理法》《药品生产监督管理办法》《药品注册管理办法》《药品上市后变更管理办法(试行)》等一系列法律法规的颁布实施,我国药品监管领域法规体系建设更加科学和现代化,对于药品的管理更加强调全生命周期管理,对于已上市生物制品的药学变更,逐渐由既往基于事项的变更转变为基于风险进行分类管理的模式,并且强调了药品上市许可持有人是上市后变更管理的责任主体。这种监管模式的转变更有利于激发企业上市后自主变更的主动性,使企业可以更灵活地基于风险和企业实际进行上市后药学变更管理,从而有助于实现生物制品的全生命周期管理,保障生物制品上市后供应。
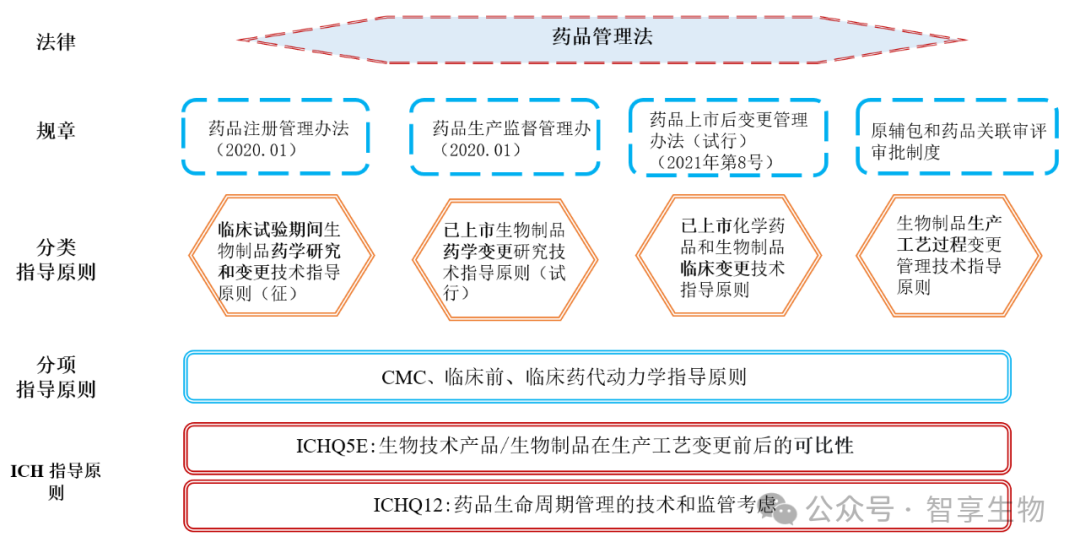
《药品上市后变更管理办法(试行)》规定,药品上市后变更不得对药品的安全性、有效性和质量可控性产生不良影响。对于任何生物制品的上市后药学变更,需要根据《已上市生物制品药学变更研究技术指导原则(试行)》开展相应的变更研究来支持变更。开展变更可比性研究是进行已上市生物制品药学变更评价的基础和关键。对于已上市生物制品的药学变更,产品可比性的确定可以药学研究为基础。但当现有药学数据对于确定可比性而言不充分时,应开展相关的非临床和(或)临床研究来获得补充性证据。
#2
上市后变更案例
近日智享生物承接的某上市后变更项目从合同签订到6000 L GMP放大生产仅用时5个月。期间完成了技术转移、国产化物料的替代、工艺优化、500 L工艺确认、6000 L放大生产等一系列关键工作。

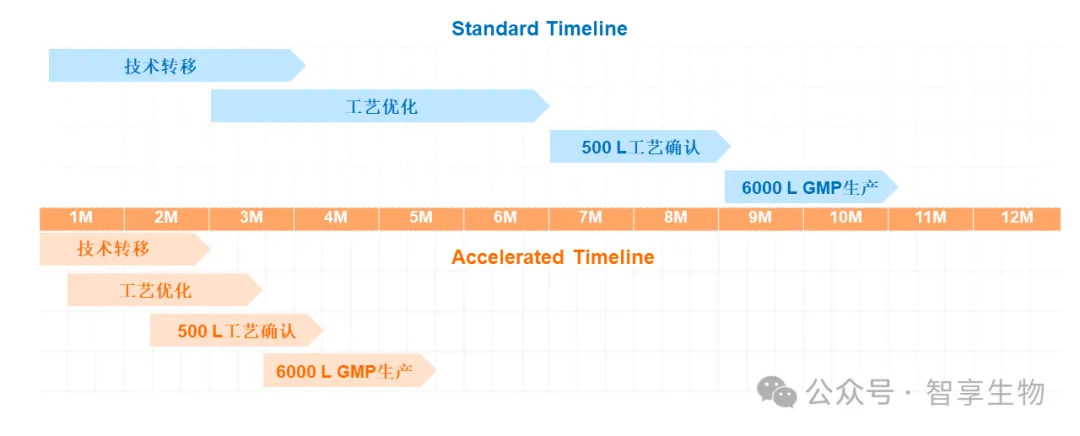
工艺转移
智享生物与客户在短短两个月的时间充分而积极的沟通,成功的一次性完成上下游原工艺转移确认工作。充分体现了双方技术团队对工艺流程的深刻理解和高效的执行力。
工艺优化
在该项目中,智享生物与客户积极探索并开发了多个新工艺优化方案,均可提升多项关键性能指标。在替换由客户筛选的国产培养基后,表达量提高至原工艺的230%,乳酸含量下降到原工艺的17%。当然新培养基的应用会引入大量相应的开发与验证工作。
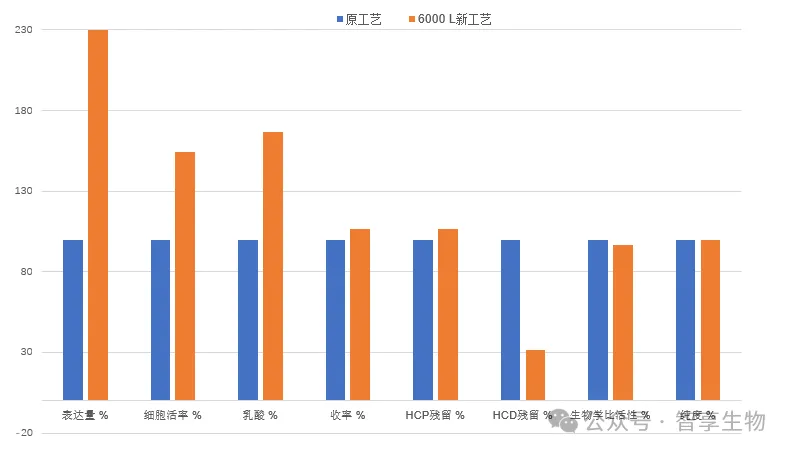

(出于数据保密原则,并未展示各项指标数值)
在上游实现高表达的同时,智享生物工艺下游团队也在短时间内给出了3套针对上游工艺变更的技术解决方案,可以兼顾高纯度和高收率的交付,收率较原工艺提升17%,关键质量与原工艺保持一致。与此同时,智享生物通过工艺优化,实现了从填料、超滤膜包、除病毒滤器等关键物料的国产化替代,使整段工艺路线100%国产化,再一次体现了智享生物实现“降本”和“增效”的硬实力,真正做到“助力客户制药”。
工艺放大
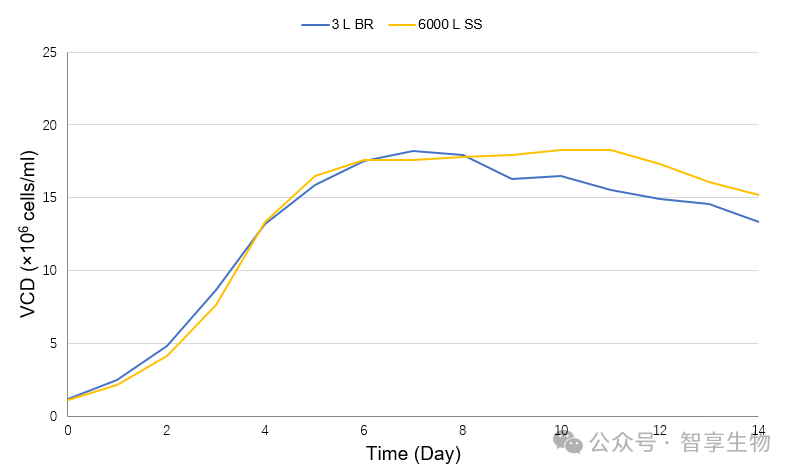
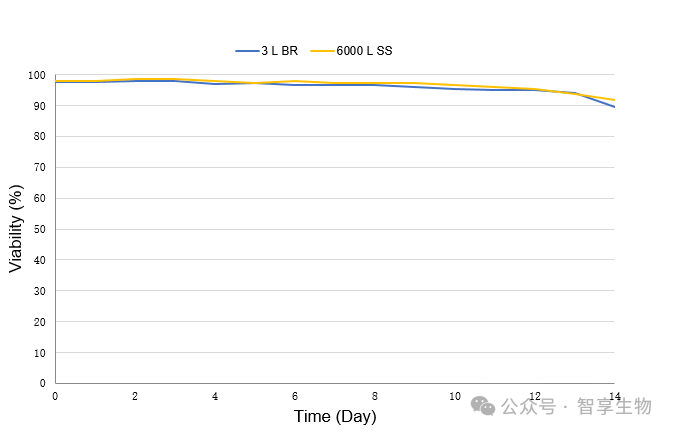
在工艺转移确认后,智享生物进一步实现了从3 L、15 L、500 L测试,到最终6000 L的工艺放大,小试与放大数据一致性较好,质量可比。