【中国 苏州】
2025年6月
摘要
宿主细胞DNA(Host Cell DNA,HCD)是指存在于生物制品中的源于宿主细胞的DNA片段或更长的分子,这类杂质可能会引起免疫原性、致癌性、感染性、干扰代谢等潜在的安全风险,因此,HCD残留量也是生物制品安全性和质量控制的关键点,需要通过多步骤纯化策略将其降低至法规允许的限值。DNA分子量大且带负电荷,易与带正电荷的蛋白质或杂质形成复合物,可基于此性质设计下游纯化工序。
案例分享
1.背景介绍
上市后变更项目,其原上市工艺采用 500 L 生产规模。为充分满足广大患者的用药需求,现将生产规模扩大至 6000 L。在此过程中,同步对上游工艺进行了优化,使蛋白表达量得到进一步提升,然而在 500 L 与 6000 L 规模测试批次的生产中发现,产品经阴离子交换层析(AEX)后,DNA 残留量高达 1,000,000 pg/mg,这一数值相较于原工艺水平 200 pg/mg,呈现出了极为显著的增加趋势。
尽管后续经过了多个下游纯化工艺步骤处理,最终产品原液中的 DNA 残留量得以符合既定的质量标准(≤ 15 pg/mg)。然而,这一看似圆满的结果背后,却潜藏着巨大的隐患——阴离子层析的病毒清除能力出现了明显减弱。这一情况无疑给产品的安全性与稳定性敲响了警钟,需要我们进一步深入探究并采取有效措施加以应对。
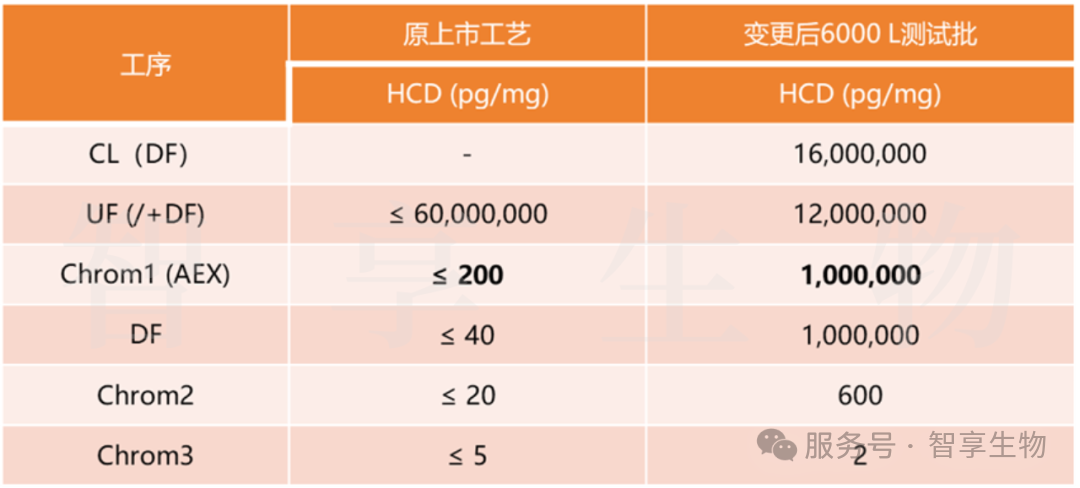

图 1.项目下游纯化相关数据(简)
2.DNA残留的潜在影响
6000 L测试批,阴离子收集液 DNA残留远超原工艺(~1,000,000 pg/mg vs ~200 pg/mg),导致AEX步骤失去对病毒的去除能力,AEX病毒LRV由2.16 log10降低为0.56 log10(不能作为病毒清除步骤),最终产品的病毒安全系数不满足法规ICH Q5A中的要求,即>6 log10。
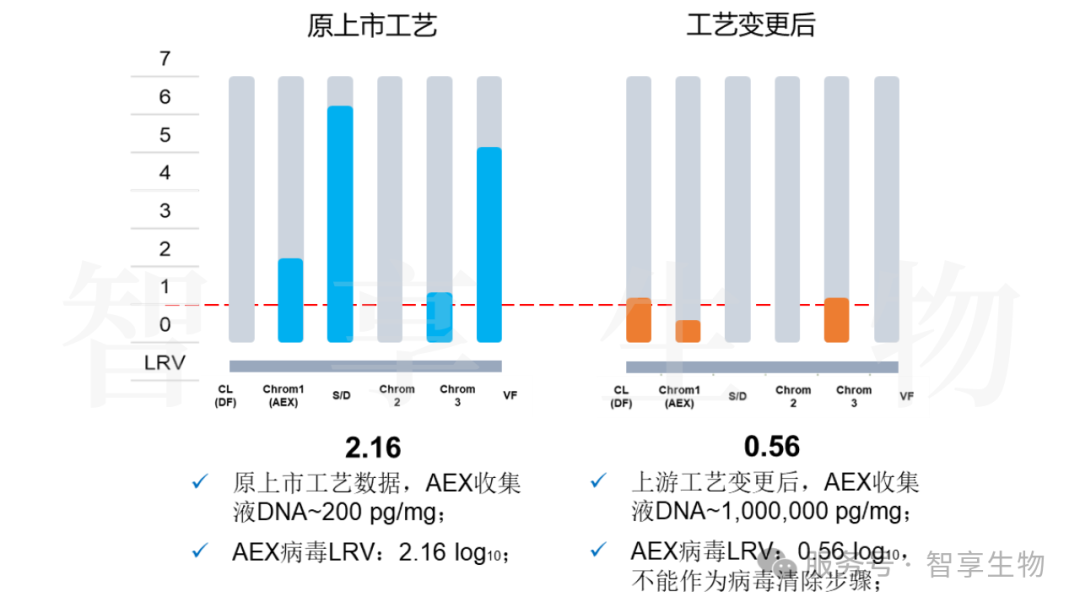

图 2.原上市工艺和工艺变更后数据对比
3. DNA去除策略
【1】. 基于带电性质差异去除DNA
通过优化AEX工艺的载量、上样pH和电导率,可显著提升AEX对DNA的去除能力,DNA残留由~7 log10降低为~2 log10,最终AEX病毒LRV为2.58 log10,和原上市工艺相当。
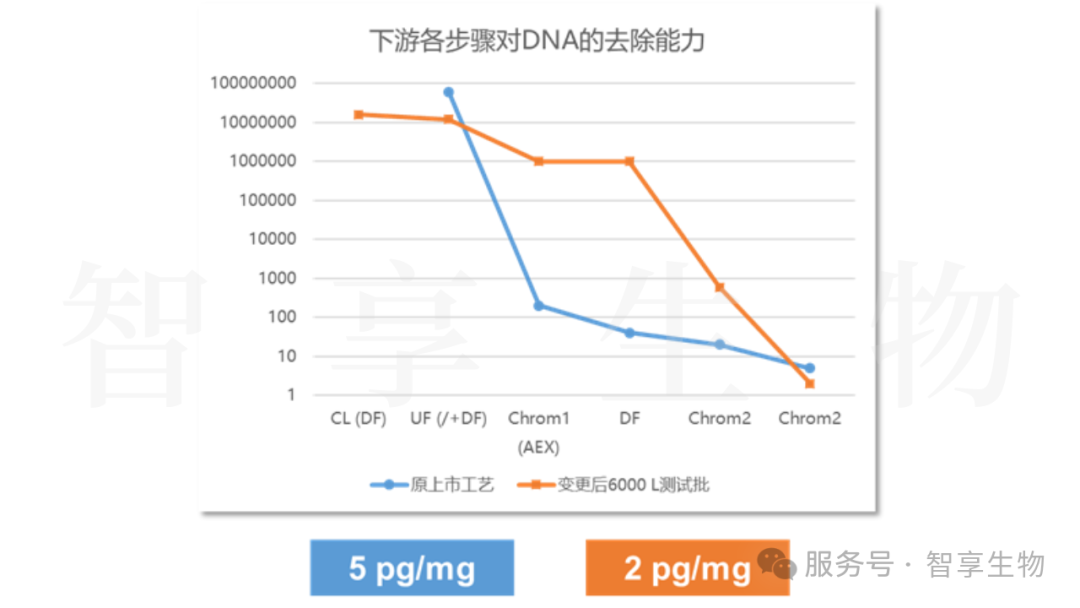

图 3.项目下游各步骤对DNA的去除能力
【2】. 基于DNA大小和带电性质差异去除DNA
基于先验知识,料液浊度与DNA含量可能存在正相关关系;对比两种澄清过滤工艺,深层过滤和中空纤维切向流微滤,进一步证实料液浊度与DNA含量存在正相关关系。通过中空纤维微滤工艺代替深层过滤,可有效降低料液的浊度(降低了90%),并大幅提升AEX对DNA的去除能力,DNA去除能力由~1.2 log10提升为~5.9 log10。
澄清收获工艺优化,可以彻底解决深层过滤问题(DNA含量),为下游DNA去除提供新的思路。
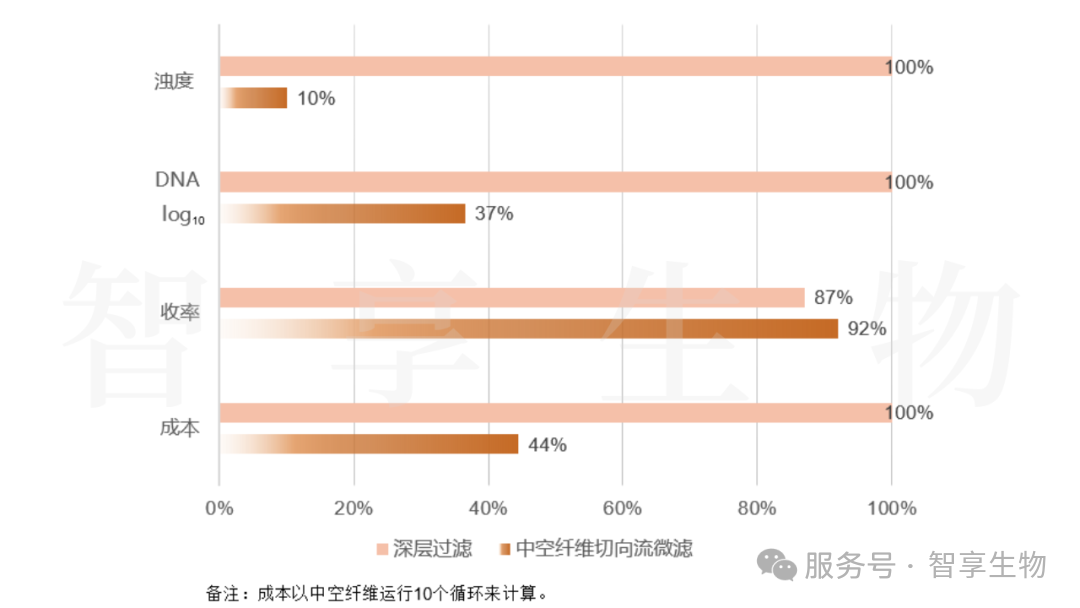

图 4.不同澄清收获工艺数据对比-1
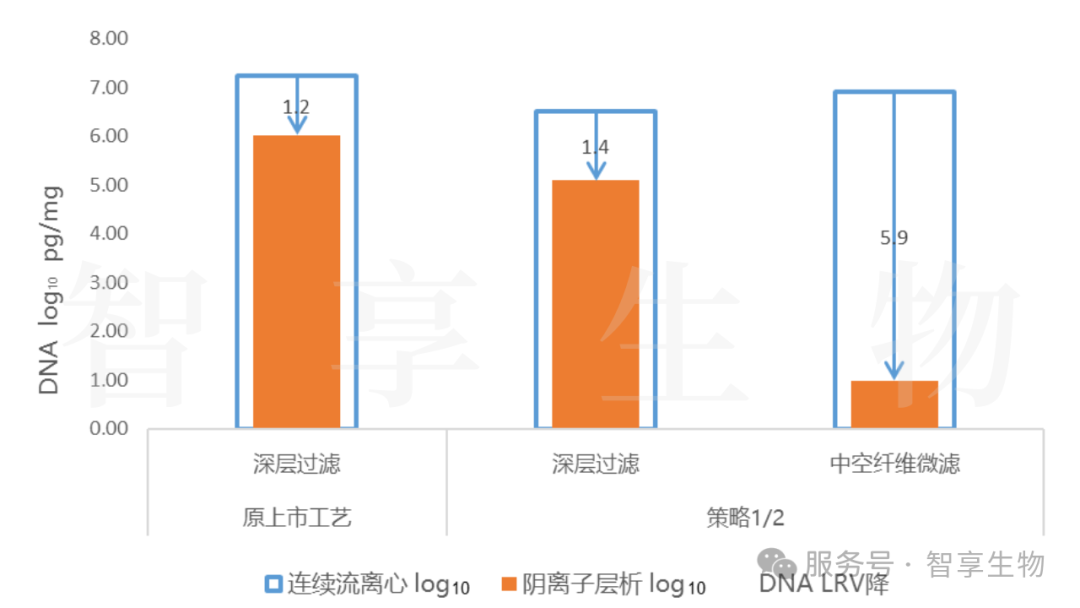

图 5.不同澄清收获工艺数据对比-2
4.结论
DNA残留作为生物制品安全性和质量控制的关键点,其含量直接影响阴离子层析工艺对病毒清除的能力。基于DNA大小和带电性质,可通过优化阴离子层析工艺和澄清收获工艺,在降低料液浊度的同时,对DNA残留进行控制。本文证实了料液浊度与DNA含量存在正相关关系,为下游DNA去除提供新的思路。
参考文献
[1] WHO Technical Report Series, No. 941, Fifty-sixth report. WHO Expert Committee on Biological Standardization, 2007.
[2] Petricciani J, Loewer J. An overview of cell DNA issues. Developments in Biological, 2001.
[3] Melani C Stone, et al. Effects of pH, conductivity, host cell protein, and DNA size distribution on DNA clearance in anion exchange chromatography media. Biotechnol Prog, 2017.
[4] ICH Q5A (R2). Guideline on viral safety evaluation of biotechnology products derived from cell lines of human or animal origin, 2024.