【中国 苏州】
2024年12月
#1 前言
“平台化”战略的核心理念是实现统一性、标准化和兼容性。然而,在推进平台化的过程中,有一点对于技术研发领域的同仁们来说是心照不宣的——“灵活性”的追求。
在中国,抗体工艺的开发这一过程曾被比喻为“摸着石头过河”,在过去不到十年的时间里,抗体融合蛋白从复杂的抗体领域中破茧而出,我们见证了一系列创新抗体结构的涌现,包括双特异性抗体、多价抗体、单链抗体和纳米抗体等。这些构型的相继问世,为工艺开发平台的灵活性提供了一个真实世界的检验场,我们得以观察和验证平台在应对多样化需求时的适应性和创新能力。
#2 150+分子,50+结构
智享生物的首秀便是承接一项双特异性抗体的IND项目,智享团队拥有处理复杂抗体工艺的深厚技术积累,在过去的六年中,智享生物成功地应对了一系列工艺开发中的挑战。目前,智享生物的专业团队已经承接并完成了150多个项目,这些项目涵盖了从临床前阶段到工艺验证,再到上市后工艺变更的全方位需求,涉及超过50种不同的分子类型。
#3 这么多分子类型,怎么做平台化?
智享生物有着丰富的下游工艺开发经验,累计开发了100多个项目的工艺,其中包括40多个单克隆抗体项目、30多个双/多特异性抗体项目、12个融合蛋白项目、15个非标签重组蛋白项目,并据此建立了四种类型的纯化平台。
不同抗体类型的开发难度
单克隆抗体:作为主流抗体类药物,多数产品已经进入到临床Ⅲ期或商业化阶段,因此工艺开发更侧重于成本控制、质量可比性。此类工艺面临诸多挑战,如电荷异构体的控制、高浓度超滤、填料寿命等。
双/多特异性抗体:双/多特异性抗体的不同抗原结合位点带来了巨大的治疗潜力,但其对下游工艺的挑战也非常多,比如产品稳定性、产品相关杂质(如聚集体、错配产品、半抗等)的去除等。
融合蛋白:通常具有分子量大或pI较低等特性,可能导致层析过程中的非特异性吸附,从而面临HCP难去除、稳定性不佳等工艺挑战。
非标签重组蛋白:具有分子设计简单、免疫原性低、成本低等优势,在重组疫苗、凝血酶、胶原蛋白领域有着广泛的应用,但因其缺乏亲和层析步骤,往往在纯度和HCP残留去除上面临诸多工艺挑战。
#4 我们的应对策略
4.1 高通量筛选策略
高效快速筛选不同厂家、不同填料基质和不同配基的填料,并对此进行DOE,以期筛选并优化得到最佳的工艺参数。
案例1:某商业化项目,因亲和填料寿命短,智享生物借助高通量筛选策略对填料清洗方法进行筛选,最终延长填料寿命至原工艺填料寿命1.5倍,成本降低至原工艺的34%。
4.2 HCP残留去除策略
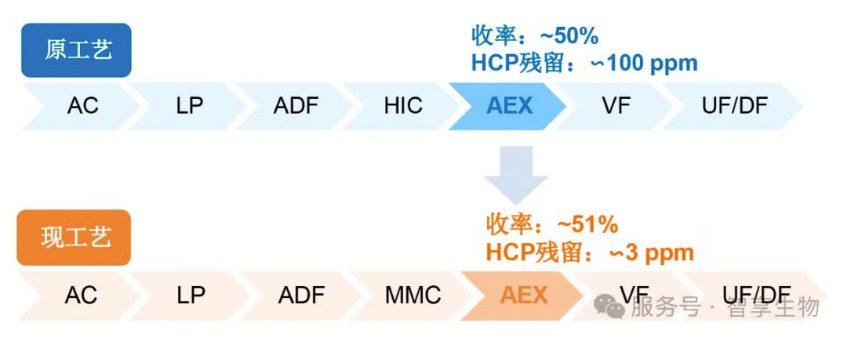
依托11个HCP残留挑战项目,通过填料筛选、层析pH、盐浓度、添加剂和温度等参数的调整,以有效去除与目的蛋白非特异性结合或pI相近的HCP。
案例2:某IND项目,分子类型为Fc融合蛋白,pI低,由于HCP中含有一定量的脂酶,导致吐温降解。智享生物借助HCP残留去除平台策略,使得在收率不变的前提下,HCP残留降低到原工艺的1/30,同时单体纯度提升2%,物料成本降低至63%。
4.3 电荷异构体控制策略:
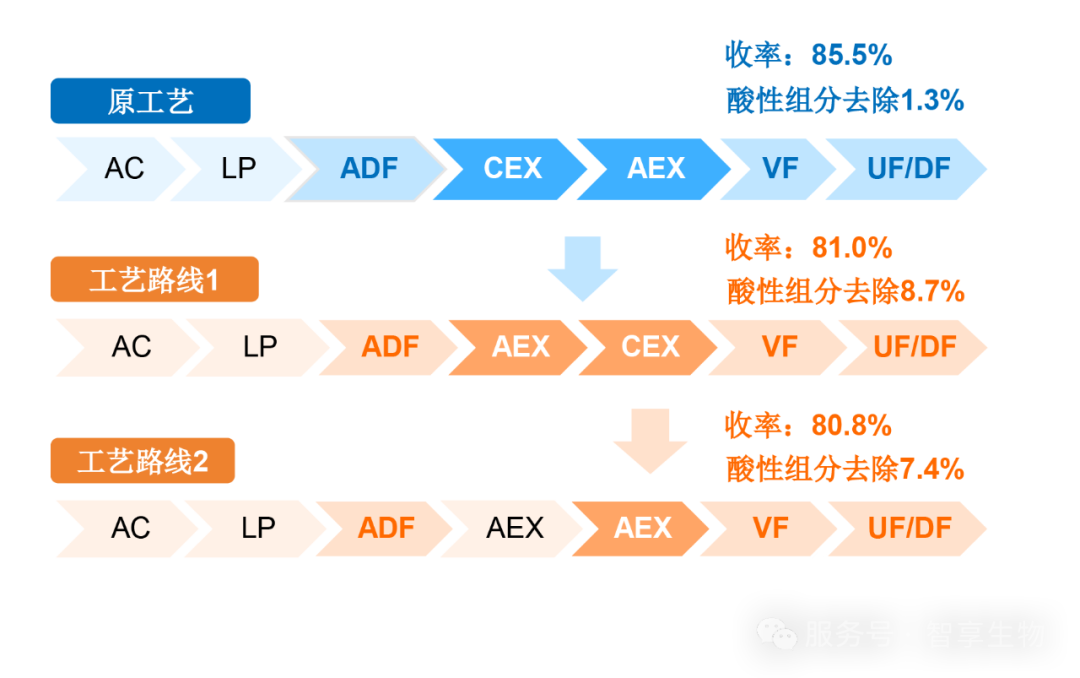
依托超过5个电荷异构体挑战项目,通过填料筛选、层析pH、盐浓度、添加剂和温度等参数的调整,优化工艺参数以期控制电荷异构体在可比性范围内,同时去除变更后出现的新的电荷异构体峰。
案例3:商业化项目,分子类型为单克隆抗体,上市后变更后上游酸性组分偏高5%以上,借助电荷异构体控制策略,给客户提供2种工艺路径选择,使得变更后的工艺酸性组分去除能力提升超过5倍。
4.4 开发新型制剂技术
探索新的制剂技术,如纳米技术或脂质体,以提高复杂抗体的稳定性和生物利用度。
#5 参考文献
[1]李智,诸葛鑫,陈紫娟. 一种非对称双特异性抗体阴离子交换层析的洗脱方法. CN117362442A,2024-01-09.
[2]李智,诸葛鑫,陈紫娟. 一种显著去除Fc融合蛋白降解片段的特殊淋洗缓冲体系. CN117820414A,2024-04-05.
[3]李智,诸葛鑫,陈紫娟. 一种超大分子的病毒过滤方法. CN116854809A,2023-10-10.
[4]A–Mab: A Case Study in Bioprocess Development. 2009 Oct, CMC Biotech Working Group.
[5]Levine H L, Cooney B R. The Development of Therapeutic Monoclonal Antibody Products - A Comprehensive Guide to CMC Activities from Clone to Clinic. BioProcess Technology Consultants, Inc. 2017 Jun.
[6]Anurag S. Rathore, Hal Baseman, Scott Rudge. Process Validation in Manufacturing of Biopharmaceuticals. 2023 Dec.
Jagschies G, Lindskog E, Galliher P. Biopharmaceutical Processing: Development, Design, and Implementation of Manufacturing Processes. 2018.
[7]Ralf Pörtner. Biopharmaceutical Manufacturing-Progress, Trends and Challenges. 2013.
[8]PDA technical report no. 14: Validation of Column-Based Chromatography Processes for the Purification of Proteins. Parenteral drug Association. 2008.
[9]PDA technical report no. 42: Process validation of protein manufacturing. Parenteral drug Association. Parenteral drug Association. 2005.
[10]Chen SW, Zhang W. Current trends and challenges in the downstream purification of bispecific antibodies. Antib Ther. 2021 May 7;4(2):73-88.
[11]Singh N, Herzer S. Downstream Processing Technologies/Capturing and Final Purification: Opportunities for Innovation, Change, and Improvement. A Review of Downstream Processing Developments in Protein Purification. Adv Biochem Eng Biotechnol. 2018;165: 115-178.
[12]Li Y. General strategies for IgG-like bispecific antibody purification. Biotechnol Prog. 2024 Oct 15: e3515.
[13]Lee HJ, Lee CM, et al. Purification of antibody fragments for the reduction of charge variants using cation exchange chromatography. J Chromatogr B Analyt Technol Biomed Life Sci. 2018 Mar 30;1080: 20-26.
[14]Fekete S, Beck A, et al. Method development for the separation of monoclonal antibody charge variants in cation exchange chromatography, Part II: pH gradient approach. J Pharm Biomed Anal. 2015 Jan;102:282-9.
[15]Ito T, Lutz H, et al. Host cell proteins in monoclonal antibody processing: Control, detection, and removal. Biotechnol Prog. 2024 Jul-Aug;40(4): e3448.